Криотерапия в дерматологии: показания и противопоказания
Криотерапия в дерматологии представляет собой контролируемое разрушение патологических тканей кожи воздействием жидкого азота с температурой −196°C. Метод применяется для удаления более 20 типов новообразований — от вирусных бородавок до предраковых кератозов — с эффективностью от 47 до 83% в зависимости от нозологии и техники проведения. Процедура длится от 10 до 120 секунд, но имеет абсолютные противопоказания при системных заболеваниях крови, холодовой аллергии и определенных аутоиммунных состояниях. Выбор криодеструкции требует понимания механизма действия холода на клеточном уровне, сравнения с альтернативными методами и оценки индивидуальных рисков осложнений.
Содержание
- 1 Что представляет собой криотерапия в дерматологии
- 2 От античности до современности: эволюция холодового лечения
- 3 При каких кожных заболеваниях назначают криотерапию
- 4 Кому процедура строго противопоказана
- 5 Контактные и бесконтактные методики: как проводят процедуру
- 6 Криотерапия против лазера и электрокоагуляции: выбор с учетом компромиссов
- 7 Какие осложнения возможны после воздействия холодом
- 8 Взгляд критика: почему криотерапия не всегда оптимальна
Что представляет собой криотерапия в дерматологии
Криотерапия представляет собой метод контролируемого разрушения патологических тканей кожи путем воздействия жидкого азота, температура кипения которого составляет −196°C. Техника применяется дерматологами с середины XX века для удаления доброкачественных и некоторых злокачественных новообразований кожи без использования скальпеля или лазера.
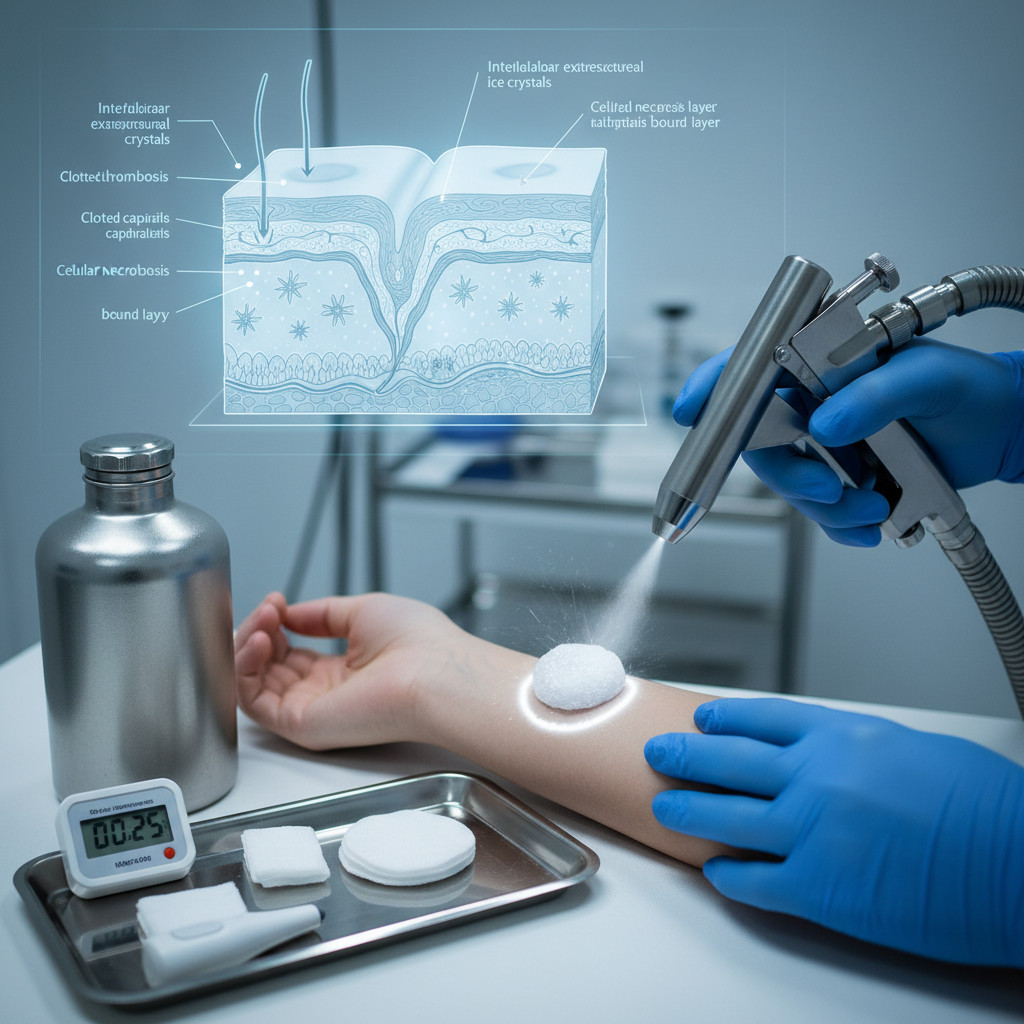
В основе метода лежит явление криодеструкции — необратимого повреждения клеток при их замораживании с последующим оттаиванием. При контакте с жидким азотом ткань охлаждается до критических значений за 10–30 секунд, что запускает цепочку биохимических процессов: внутри- и внеклеточная кристаллизация воды, механическое повреждение клеточных мембран кристаллами льда, денатурация белков и фосфолипидов. Параллельно происходит тромбоз сосудов микроциркуляторного русла, что приводит к ишемическому некрозу обработанной зоны без повреждения окружающих здоровых тканей.
Метод востребован благодаря простоте исполнения и доступности: для проведения процедуры требуется минимальное оборудование, отсутствует необходимость в инъекционной анестезии, а время манипуляции редко превышает 2–3 минуты. Современные клиники предлагают удаление папиллом азотом в Москве как амбулаторную процедуру без госпитализации и длительного периода реабилитации. Исследования демонстрируют эффективность от 39% до 98,8% в зависимости от типа новообразования, локализации и протокола замораживания: для актинического кератоза показатель составляет 39–83%, для бородавок на руках — 47% при трехмесячном курсе с интервалом в три недели, для себорейного кератоза — выше 80%.
По данным американских исследований 2004 года, криохирургия требует минимальной подготовки, не вызывает значительного риска инфицирования и не требует возвращения пациента для снятия швов, что делает её оптимальной для амбулаторной дерматологической практики.
Компромисс метода заключается в отсутствии гистологического контроля удаленной ткани — в отличие от хирургического иссечения, после криодеструкции невозможно провести микроскопическое исследование образца. Это ограничивает применение при подозрении на атипичные или злокачественные клетки, когда требуется подтверждение диагноза. Кроме того, метод менее предсказуем при работе с темной кожей: риск стойких пигментных изменений у пациентов с фототипами IV–VI по Фитцпатрику достигает 30–40%, что требует индивидуальной оценки соотношения пользы и косметических последствий.
Как жидкий азот разрушает патологические ткани
Механизм разрушения тканей жидким азотом реализуется через последовательность трех взаимосвязанных процессов: физическое повреждение клеточных структур кристаллами льда, осмотический шок от дегидратации и сосудистый коллапс. При контакте с кожей жидкий азот мгновенно отнимает тепло, снижая температуру поверхностных слоев до −25…−50°C в течение первых 30 секунд экспозиции.
Первая фаза повреждения — кристаллизация воды. Сверхбыстрое охлаждение приводит к формированию микрокристаллов льда сначала во внеклеточном пространстве, затем — внутри клеток. Образовавшиеся кристаллы механически разрывают плазматические мембраны, нарушая целостность клеточных органелл. Этот процесс сопровождается резким повышением концентрации электролитов в цитоплазме: по мере того как вода превращается в лед, растворенные соли остаются в жидкой фазе, создавая гиперосмолярную среду, несовместимую с жизнью клетки.
| Фаза криодеструкции | Временной интервал | Ключевые процессы |
|---|---|---|
| Криопоражение | 0–24 часа | Образование кристаллов льда, дегидратация клеток, отек тканей, изменение цвета кожи |
| Крионекротическая фаза | 1–7 суток | Тромбоз сосудов микроциркуляции, ишемия, развитие некроза тканей |
| Репарация | 7–21 сутки | Восстановление эпителиального пласта, формирование новой ткани |
Вторая фаза — сосудистый тромбоз. Холод вызывает немедленный спазм капилляров и артериол с последующим парадоксальным расширением (феномен «холодовой вазодилатации»). Однако при достижении критических температур эндотелий сосудов повреждается, запуская каскад свертывания крови. В течение 12–24 часов после процедуры формируются множественные микротромбы, полностью перекрывающие кровоток в зоне обработки. Развивается ишемический некроз — отмирание тканей из-за отсутствия кислорода и питательных веществ.
Третья фаза — денатурация белков. Низкие температуры разрушают третичную структуру белковых молекул, превращая их в нефункциональные агрегаты. Разрушаются ферментные системы клетки, прекращается синтез АТФ, останавливаются все метаболические процессы. Параллельно активируются лизосомальные ферменты — биологические «ножницы», которые разрезают поврежденные клеточные структуры на фрагменты для последующей утилизации иммунными клетками.
Почему повторное замораживание эффективнее одиночного цикла
Исследование 1994 года, опубликованное в British Journal of Dermatology, показало, что двойной цикл заморозки-оттаивания повышает эффективность лечения подошвенных бородавок с 41% до 65%. Механизм связан с тем, что при первом замораживании часть клеток выживает за счет адаптивных механизмов и образования антифризных белков. Повторное охлаждение разрушает эти защитные структуры, доводя некроз до глубоких слоев дермы. Однако для бородавок на руках преимущество двойного цикла не доказано, а риск осложнений (пузыри, боль) возрастает с 44% до 64%.
Аналогия с промышленным процессом: криодеструкция подобна шоковой заморозке продуктов питания, где критическая скорость охлаждения определяет размер кристаллов льда. Чем быстрее заморозка, тем мельче кристаллы и тем сильнее механическое повреждение. В дерматологии этот принцип реализуется через распыление жидкого азота под давлением, обеспечивающее скорость охлаждения до 50°C в секунду — достаточную для формирования микрокристаллов, разрывающих клетки изнутри.

Какие температуры используются при криодеструкции
Температурные режимы криодеструкции различаются в зависимости от характера новообразования: для удаления доброкачественных поражений достаточно охлаждения ткани до −20…−30°C, тогда как злокачественные образования требуют более глубокой заморозки до −40…−50°C. Эти значения достигаются в глубине тканей, а не на поверхности кожи, где температура приближается к температуре жидкого азота (−196°C).
Градиент температур формируется по мере проникновения холода вглубь дермы. При распылении жидкого азота в течение 10 секунд поверхность кожи охлаждается до −60…−80°C, на глубине 2 мм температура составляет −30…−40°C, на глубине 5 мм — около −10…−15°C. Латеральное распространение холода также имеет значение: зона поражения распространяется на 3–5 мм за границы визуально обработанной области, что учитывается при планировании краев резекции.
- Критическая температура клеточной смерти
- Температура, при которой происходит необратимое повреждение 50% клеток в обработанной зоне. Для эпидермиса составляет −20°C, для меланоцитов (пигментных клеток) −5…−7°C, что объясняет частоту гипопигментации после криотерапии.
- Время заморозки
- Длительность непрерывного контакта жидкого азота с кожей. Варьирует от 5–10 секунд для тонких актинических кератозов до 20–40 секунд для глубоких вирусных бородавок и 60–120 секунд для злокачественных новообразований.
- Время оттаивания
- Период возвращения ткани к физиологической температуре. Составляет обычно в 1,5–2 раза больше времени заморозки. Медленное оттаивание усиливает повреждение за счет роста внутриклеточных кристаллов льда и продолжительной ишемии.
Исследование Mota и соавторов (по данным анализа рефлекционной конфокальной микроскопии) продемонстрировало, что протокол с двумя циклами замораживания по 10 секунд каждый превосходит одиночный 10-секундный цикл по глубине проникновения холода и степени воспалительного ответа без увеличения частоты осложнений. Thai и коллеги установили, что увеличение времени замораживания с 5 до 20 секунд повышает эффективность удаления актинических кератозов с 39% до 83% при трехмесячном наблюдении.
Выбор температурного режима — это инженерный компромисс между эффективностью деструкции и риском осложнений. Агрессивные протоколы (экспозиция более 20 секунд, двойной цикл) обеспечивают полное разрушение патологических тканей, но увеличивают вероятность образования выраженных пузырей (64% против 44% при стандартном режиме), стойкой гипопигментации (до 30% у светлокожих пациентов) и болевых ощущений. Консервативные режимы (5–10 секунд, одиночный цикл) минимизируют побочные эффекты, но требуют повторных сеансов с интервалом 2–3 недели для достижения клинического результата.
Согласно руководству Американской академии семейных врачей (AAFP, 2004), для большинства доброкачественных поражений кожи оптимальное время одиночной заморозки составляет 10–20 секунд, что позволяет достичь температуры −25…−30°C на глубине 3 мм — достаточной для некроза патологических клеток с минимальным повреждением здоровых тканей.
Метод контроля температуры при криотерапии остается проблемой: большинство дерматологов ориентируются на визуальные признаки (формирование ледяного шарика, побеление кожи) и тактильные ощущения, что вносит субъективность в процедуру. Использование инфракрасных температурных датчиков, стандартизирующих целевую температуру на уровне −5°C на поверхности, позволяет достичь почти 100% эффективности по данным исследования Goldberg и соавторов, но такое оборудование пока недоступно в большинстве клиник России.
От античности до современности: эволюция холодового лечения
Применение холода в медицинских целях документировано на протяжении более 5500 лет: первые свидетельства относятся к 3500 году до нашей эры, когда целители древних цивилизаций использовали охлаждение для снятия воспаления и боли. Гиппократ (460–370 гг. до н.э.) систематически применял холодную воду для лечения растяжений, переломов и подагрических опухолей, а его последователи Гален, Цельс и Авиценна расширили список показаний, включив инфицированные раны и черепно-мозговые травмы.
Переломный момент наступил в 1851 году, когда британский врач Джеймс Арнотт впервые описал применение солевых растворов со льдом при температуре −18…−24°C для заморозки прогрессирующих опухолей молочной железы, шейки матки и кожи. Его наблюдения показали уменьшение размеров новообразований и снижение интенсивности болевого синдрома, что открыло эпоху научной криомедицины. Арнотт спроектировал специальный аппарат для подачи холода, представленный на Великой выставке в Лондоне, однако устройство оказалось громоздким и малоэффективным для широкого использования.
Революция произошла в 1899 году, когда нью-йоркский дерматолог Кэмпбелл Уайт стал первым, кто применил жидкий воздух (температура −190°C) в клинической практике. Он использовал ватные тампоны, распылители и латунные роликовые устройства для лечения красной волчанки, опоясывающего лишая, бородавок, сосудистых родимых пятен и эпителиом. Параллельно врач Уильям Пьюзи продемонстрировал чрезвычайную чувствительность меланоцитов к холоду: его фотодокументация успешного обесцвечивания крупного волосяного невуса на лице девочки стала одним из первых доказательств избирательного действия низких температур на пигментные клетки.
В 1961 году американский нейрохирург Ирвинг Купер описал аппарат с жидким азотом в качестве хладоагента (точка кипения −196°C), подаваемого к патологическим тканям через криозонд — это изобретение легло в основу всех современных систем криодеструкции.
| Период | Ключевое событие | Температура/Технология |
|---|---|---|
| 3500 г. до н.э. | Первое документированное применение холода в медицине | Естественный лёд, снег |
| 460–370 гг. до н.э. | Гиппократ систематизирует холодовую терапию | Холодная вода, компрессы со льдом |
| 1851 г. | Джеймс Арнотт применяет солевые растворы со льдом для опухолей | −18…−24°C |
| 1899 г. | Кэмпбелл Уайт вводит в практику жидкий воздух | −190°C |
| 1961 г. | Ирвинг Купер создает криозонд с жидким азотом | −196°C |
| 1970-е гг. | Тосимо Ямаучи разрабатывает экстремальную криотерапию для суставов | −100…−180°C (криокамеры) |
В последней четверти XX века японский ученый Тосимо Ямаучи, наблюдая за пациентами с ревматоидным артритом, обнаружил выраженный противовоспалительный эффект экстремального охлаждения. К середине 1970-х он предложил использовать в лечебных целях воздух, охлажденный до −100…−180°C, что привело к созданию криокамер общего воздействия. Параллельно в дерматологии совершенствовались техники локального криовоздействия: появились распылительные системы с регулируемым давлением, контактные криозонды разных диаметров и формы для обработки новообразований различной локализации.
Современная криодерматология представляет компромисс между эффективностью и безопасностью. Преимущество ранних агрессивных протоколов XIX века заключалось в радикальном разрушении патологических тканей, однако цена выбора включала обширные некрозы, рубцевание и отсутствие контроля глубины воздействия. Современные стандартизированные методики с использованием жидкого азота обеспечивают прогнозируемую глубину заморозки, минимальное повреждение здоровых тканей и сокращение периода реабилитации до 7–14 дней против 4–6 недель при исторических методах.
При каких кожных заболеваниях назначают криотерапию
Криотерапия показана для лечения более 30 нозологических форм дерматологических заболеваний, охватывающих доброкачественные новообразования, предраковые состояния, вирусные инфекции кожи и отдельные формы злокачественных опухолей на ранних стадиях. Метод классифицируется как абляционно-деструктивный: он физически уничтожает патологические клетки без возможности гистологического исследования удаленного материала, что ограничивает применение при сомнительном диагнозе.
Основные категории показаний включают: вирусные поражения, ассоциированные с вирусом папилломы человека (вульгарные, подошвенные, плоские бородавки, остроконечные кондиломы), доброкачественные эпителиальные новообразования (себорейные кератозы, кератоакантомы, дерматофибромы), предраковые дерматозы (актинические кератозы, болезнь Боуэна), ограниченные формы злокачественных опухолей (поверхностная базальноклеточная карцинома диаметром до 2 см), сосудистые аномалии (капиллярные гемангиомы, телеангиэктазии), пигментные поражения (лентиго, хлоазма) и гипертрофические рубцы с келоидами.
- Актинический кератоз
- Предраковое заболевание кожи, вызванное хроническим воздействием ультрафиолета. Криотерапия обеспечивает полное разрешение в 72–83% случаев при экспозиции 10–20 секунд, признана методом первой линии при единичных очагах.
- Себорейный кератоз
- Доброкачественное эпителиальное новообразование, типичное для лиц старше 50 лет. Эффективность криодеструкции превышает 85% при одиночном 10-секундном цикле замораживания.
- Контагиозный моллюск
- Вирусное поражение кожи, вызываемое поксвирусом. Криотерапия демонстрирует высокую эффективность с быстрым клиренсом при множественных резистентных поражениях, обычно требует 2–3 сеанса с интервалом 2 недели.
Выбор криотерапии как метода лечения определяется соотношением эффективности и инвазивности. Для вульгарных бородавок на руках метод демонстрирует 47–65% успеха при курсе из трех процедур с трехнедельным интервалом — это ниже, чем у хирургического иссечения (85–95%), но выше, чем у топических кератолитиков (20–30%). При подошвенных бородавках двойной цикл заморозки повышает результативность до 65% против 41% при одиночном цикле, однако риск образования болезненных пузырей возрастает с 44% до 64%.
Исследование эффективности различных методов лечения актинического кератоза показало, что при длительном наблюдении криотерапия превосходит CO?-лазер: через 12 месяцев 66,8% пациентов остаются без рецидивов после криодеструкции против 37% в лазерной группе.
Ограничения метода связаны с локализацией и характером новообразования. Криотерапию не рекомендуется применять при опухолях на коже волосистой части головы и в носогубных складках из-за высокого риска рецидива (до 40%), при подозрении на меланому или атипичные невусы (невозможность гистологической верификации), при поражениях толщиной более 3 мм (недостаточная глубина проникновения холода) и в периорбитальной зоне (риск повреждения конъюнктивы и роговицы). Для базальноклеточного рака требуется достижение температуры −50°C в глубине тканей с двумя циклами замораживания по 60–90 секунд, что сопровождается выраженным отеком и длительным заживлением.
Почему криотерапия неэффективна при грибковых инфекциях
Несмотря на способность низких температур разрушать клетки грибов in vitro, криодеструкция не используется для лечения микозов кожи. Причина в том, что грибковая инфекция распространяется диффузно по всей толще эпидермиса и в роговом слое, а холод воздействует только на локальный участок ограниченной глубины. После заморозки окружающие жизнеспособные грибковые элементы быстро колонизируют поврежденную зону. Эффективность топических антимикотиков (тербинафин, клотримазол) достигает 80–90% при курсовом применении, тогда как криотерапия демонстрирует менее 15% успеха с высоким риском рецидива в первые 4 недели.
Анализ 25-летней практики применения криодеструкции в дерматологии показывает, что метод оптимален для пациентов с единичными или малочисленными (до 5–7) четко очерченными доброкачественными новообразованиями без признаков атипии, расположенными на участках кожи с хорошим кровоснабжением (лицо, шея, туловище, разгибательные поверхности конечностей). Для множественных диссеминированных поражений или обширных зон полевой канцеризации предпочтение отдается топическим методам (5-фторурацил, имихимод) или фотодинамической терапии.
Доброкачественные новообразования и вирусные поражения
Доброкачественные новообразования составляют до 70% от всех показаний к криодеструкции в амбулаторной дерматологической практике. В эту группу входят себорейные кератозы, кератоакантомы, фибромы, липомы небольших размеров, дерматофибромы и сосудистые образования типа старческих ангиом. Эффективность метода для таких поражений варьирует от 80% до 98,8% при правильном подборе времени экспозиции и глубины заморозки.
Себорейный кератоз — наиболее частое доброкачественное эпителиальное новообразование у лиц старше 50 лет, представляющее собой чётко очерченные коричневые или чёрные бляшки с «прилепленным» видом. Криодеструкция с экспозицией 8–12 секунд обеспечивает полное удаление в 85–90% случаев за один сеанс. Компромисс заключается в риске гипопигментации: после удаления тёмных себорейных кератозов на месте воздействия формируется белесое пятно у 25–30% пациентов, что особенно заметно на загорелой или смуглой коже. Альтернативный подход — кюретаж с электрокоагуляцией — позволяет контролировать глубину воздействия и минимизирует пигментные изменения, но требует инъекционной анестезии.
Вирусные поражения кожи, ассоциированные с вирусом папилломы человека (ВПЧ), представляют вторую по распространённости группу показаний. Криотерапия воздействует на бородавки двумя путями: прямым разрушением инфицированных вирусом кератиноцитов при замораживании и стимуляцией локального иммунного ответа через высвобождение вирусных антигенов из погибших клеток. Исследования показывают, что для вульгарных бородавок на кистях рук эффективность составляет 47% при трёх процедурах с интервалом 3 недели, для подошвенных бородавок — 41–65% в зависимости от протокола заморозки.
| Тип поражения | Эффективность криотерапии | Количество сеансов | Риск рецидива |
|---|---|---|---|
| Себорейный кератоз | 85–90% | 1 | Менее 5% |
| Вульгарные бородавки (руки) | 47–65% | 2–3 | 20–30% |
| Подошвенные бородавки | 41–65% | 3–4 | 30–40% |
| Контагиозный моллюск | 75–85% | 2–3 | 15–20% |
| Остроконечные кондиломы | 63–88% | 3–4 | 25–35% |
| Кератоакантома | 70–80% | 1–2 | 10–15% |
Особенность лечения подошвенных бородавок заключается в необходимости предварительного удаления гиперкератотического слоя: парирование (механическое удаление омертвевшей кожи скальпелем) перед замораживанием повышает эффективность на 18–25%, поскольку обеспечивает более глубокое проникновение холода к вирус-инфицированным клеткам базального слоя. Двойной цикл замораживания с полным оттаиванием между циклами увеличивает успех с 41% до 65%, однако сопровождается образованием крупных напряжённых пузырей у 64% пациентов против 44% при одиночном цикле.
Контагиозный моллюск, вызываемый поксвирусом, особенно распространён у детей и пациентов с иммунодефицитом. Криотерапия обеспечивает быстрый клиренс при множественных резистентных элементах: экспозиция 5–10 секунд на каждый узелок приводит к полному разрешению в 75–85% случаев. Альтернативой является механическое выдавливание содержимого пинцетом или кюреткой — метод даёт немедленный эффект, но болезненен для детей и требует местной анестезии кремом с лидокаином.
Рандомизированное исследование методов лечения наружных генитальных бородавок продемонстрировало, что криохирургия превосходит по эффективности подофиллин (63% против 42%), сопоставима с трихлоруксусной кислотой (63% против 61%), но уступает электродессикации и хирургическому иссечению (85–90%).
Цена выбора криотерапии для вирусных поражений — отсутствие гарантии полной элиминации вируса. ВПЧ персистирует в клинически здоровой коже на расстоянии 5–7 мм от видимых границ бородавки, что объясняет рецидивы в 20–40% случаев в течение 6 месяцев. Дополнение криодеструкции системными иммуномодуляторами (инозин пранобекс) или топическими противовирусными средствами (имихимод 5%) снижает частоту рецидивов до 12–15%, но удлиняет общий курс лечения до 8–12 недель.
Для кератоакантом — быстрорастущих доброкачественных опухолей с кратерообразным центром — криодеструкция применяется с осторожностью из-за сложности дифференциальной диагностики с плоскоклеточным раком. Протокол включает 20-секундную заморозку с захватом 2–3 мм здоровой ткани, эффективность составляет 70–80%, однако при размерах образования более 2 см предпочтение отдаётся хирургическому иссечению с гистологическим исследованием для исключения малигнизации.
Почему криотерапия вирусных бородавок требует повторных сеансов
Однократная криодеструкция разрушает только поверхностную часть бородавки на глубину 2–3 мм, тогда как ВПЧ-инфицированные кератиноциты могут располагаться на глубине до 5 мм в дерме. После первого сеанса видимая часть бородавки отпадает через 7–10 дней, но остаточные вирус-содержащие клетки инициируют рост новой папилломы. Повторные сеансы с интервалом 2–3 недели позволяют последовательно уничтожать глубже расположенные очаги инфекции. Исследования показывают, что три процедуры с трёхнедельным интервалом обеспечивают 47% излечения против 15–20% при однократной обработке.
Хронические дерматозы и воспалительные состояния
Хронические дерматозы с аутоиммунным и воспалительным компонентом представляют дискуссионную область применения криотерапии: метод демонстрирует модулирующее влияние на иммунную систему и воспалительный каскад, однако эффективность варьирует от 35% до 84% в зависимости от нозологии, стадии заболевания и типа криовоздействия. Основные показания в этой группе включают псориаз, атопический дерматит, экзему, красный плоский лишай и гипертрофические рубцы.
Для псориаза применяют две разновидности криотерапии: локальную (ЛКТ) для обработки отдельных бляшек жидким азотом и общую (ОКТ) в криокамерах при температуре −110…−180°C для воздействия на патогенетические механизмы заболевания. Исследование с участием 280 пациентов показало, что комплексное лечение с включением криотерапии снижает индекс PASI на 84% к 28-му дню терапии против 45–50% при стандартном лечении без криовоздействия. Механизм связан с подавлением провоспалительных цитокинов, улучшением микроциркуляции в зоне поражения и нормализацией эпидермальной пролиферации.
Локальная криотерапия псориатических бляшек предполагает 5–10-секундную экспозицию жидким азотом с захватом 2 мм здоровой кожи, процедуры проводятся 2 раза в неделю курсом из 10–15 сеансов. Компромисс заключается в ограниченной эффективности при распространённых формах: метод оптимален для ограниченного бляшечного псориаза с поражением менее 10% площади тела, тогда как при обширных высыпаниях предпочтительна системная терапия биологическими препаратами или фототерапия. Цена выбора — риск феномена Кёбнера (появление новых псориатических элементов в месте травматизации кожи) у 15–20% пациентов после агрессивного замораживания.
Даже один курс общей криотерапии из 25 процедур значительно улучшает прогноз достижения ремиссии при псориазе за счёт системного противовоспалительного эффекта, снижения уровня С-реактивного белка на 40–60% и нормализации липидного профиля крови.
Атопический дерматит (диффузный нейродермит) реагирует на криотерапию через модуляцию Th1/Th2 баланса и снижение продукции IgE. После 4–5-й криопроцедуры большинство пациентов отмечают значительное уменьшение зуда и шелушения кожи, что повышает качество жизни. Протокол включает обработку очагов поражения распылением жидкого азота экспозицией 3–5 секунд, курс составляет 8–12 процедур с интервалом 3–5 дней. Эффективность для лихенизированных форм достигает 65–70%, тогда как для острой экссудативной фазы метод противопоказан из-за риска усиления воспаления.
- Красный плоский лишай
- Хронический дерматоз с папулёзными высыпаниями, сопровождающимися интенсивным зудом. Криодеструкция единичных элементов экспозицией 8–12 секунд обеспечивает разрешение в 70–75% случаев, но требует осторожности при распространённых формах.
- Гипертрофические рубцы и келоиды
- Избыточное разрастание соединительной ткани в зоне заживления ран. Криотерапия с экспозицией 20–30 секунд уменьшает объём рубца на 50–70% за курс из 3–5 процедур с месячным интервалом, подавляя фибробласты и стимулируя ремоделирование коллагена.
- Экзема
- Воспалительное заболевание кожи с полиморфными высыпаниями. Криолечение применяют в подострой и хронической стадиях для уменьшения инфильтрации и зуда, эффективность составляет 55–65% при курсе 10–12 процедур.
Аналогия с системой кондиционирования: криотерапия при дерматозах работает как охлаждение перегретого процессора — она не устраняет причину «перегрева» (аутоиммунный процесс), но снижает интенсивность воспалительного ответа, давая организму время для восстановления баланса. Однако без параллельной базисной терапии (топические кортикостероиды, иммуномодуляторы) эффект криотерапии краткосрочен: ремиссия длится 2–4 месяца против 6–12 месяцев при комбинированном лечении.
Почему криотерапия эффективна при келоидах, но не устраняет их полностью
Келоиды формируются из-за дисбаланса между синтезом и деградацией коллагена: фибробласты продуцируют избыточное количество коллагена I и III типов, который не разрушается металлопротеиназами. Криодеструкция вызывает гибель части фибробластов, разрыв коллагеновых волокон кристаллами льда и активацию апоптоза избыточных клеток. Исследования показывают уменьшение высоты келоида на 50–70% и снижение зуда/болезненности на 80–90%. Однако полное исчезновение происходит редко (менее 15% случаев), поскольку остаточные фибробласты возобновляют избыточную продукцию коллагена. Оптимальный результат достигается при сочетании криотерапии с внутриочаговым введением триамцинолона: комбинация даёт 85% успеха против 55–60% при монотерапии.
Критический анализ показывает, что криотерапия при хронических дерматозах занимает нишу вспомогательного метода, неспособного заменить патогенетическую терапию. Преимущества включают отсутствие системных побочных эффектов, минимальную инвазивность и быстрое облегчение субъективных симптомов. Недостатки — необходимость повторных курсов каждые 3–6 месяцев, риск гипо- и гиперпигментации (до 35% при тёмной коже), отсутствие влияния на причину заболевания. Метод оптимален для пациентов с ограниченными формами дерматозов, резистентных к топической терапии, но не готовых к системной иммуносупрессии.
Кому процедура строго противопоказана
Криотерапия имеет абсолютные и относительные противопоказания, разделение между которыми определяется степенью риска жизнеугрожающих осложнений. Абсолютные противопоказания исключают применение метода в любой форме из-за высокой вероятности декомпенсации состояния, тогда как относительные допускают проведение процедуры после коррекции сопутствующей патологии или с модификацией протокола.
К абсолютным противопоказаниям относятся холодовые формы гиперчувствительности — группа редких иммунологических нарушений, при которых воздействие низких температур запускает патологические реакции. Холодовая крапивница (холодовая аллергия) характеризуется высвобождением гистамина при охлаждении с последующим согреванием, что приводит к появлению красных зудящих волдырей на коже. В тяжёлых случаях возможен анафилактический шок с падением артериального давления и бронхоспазмом — описаны летальные исходы после погружения в холодную воду.
Синдром Рейно представляет противопоказание из-за патологического спазма мелких артерий и артериол в ответ на холодовой стимул. При этом заболевании кратковременное охлаждение вызывает трёхфазную реакцию сосудов: выраженную бледность (ишемия), синюшность (цианоз) и реактивное покраснение (гиперемия), сопровождающиеся болью и онемением. Криотерапия может спровоцировать длительный вазоспазм с развитием некроза дистальных фаланг пальцев, зарегистрированы случаи ампутации после неосторожного применения криодеструкции у пациентов с нераспознанным синдромом Рейно.
| Противопоказание | Механизм осложнения | Риск при нарушении запрета |
|---|---|---|
| Холодовая крапивница | Высвобождение гистамина, дегрануляция тучных клеток | Анафилактический шок, отёк Квинке |
| Синдром Рейно | Патологический вазоспазм, ишемия тканей | Некроз пальцев, язвы кожи |
| Криоглобулинемия | Преципитация криоглобулинов, окклюзия сосудов | Пурпура, язвы, почечная недостаточность |
| Пароксизмальная холодовая гемоглобинурия | Гемолиз эритроцитов, высвобождение гемоглобина | Острая почечная недостаточность, анемия |
| Беременность (I триместр) | Стрессовая реакция на холод, гормональные сдвиги | Угроза прерывания беременности |
| Тяжёлая артериальная гипертензия (≥180/110) | Холодовой спазм сосудов, резкий подъём давления | Инсульт, инфаркт миокарда, гипертонический криз |
Криоглобулинемия — состояние, при котором в крови циркулируют аномальные белки (криоглобулины), выпадающие в осадок при температуре ниже 37°C. При охлаждении кожи криоглобулины преципитируют в мелких сосудах, вызывая их окклюзию с развитием пурпуры (геморрагической сыпи), некроза кожи и поражения почек. Пароксизмальная холодовая гемоглобинурия — ещё более редкое состояние, при котором холод индуцирует массивный гемолиз эритроцитов с появлением тёмной мочи (из-за гемоглобина) и риском острой почечной недостаточности.
Исследование 2021 года описывает случай развития распространённой холодовой крапивницы у пациента после криотерапии бородавки на пальце: через 15 минут после процедуры появились уртикарные высыпания на всём теле с ангиоотёком лица, потребовавшие экстренного введения адреналина и госпитализации.
К абсолютным противопоказаниям также относят острые декомпенсированные состояния: инфаркт миокарда в острой фазе (первые 3 месяца), нестабильную стенокардию, тяжёлую сердечную недостаточность III–IV функционального класса, тромбоэмболию лёгочной артерии, облитерирующие заболевания периферических артерий (атеросклероз, эндартериит, васкулиты), анемию с уровнем гемоглобина ниже 80 г/л. Холодовое воздействие при этих состояниях может спровоцировать катастрофические осложнения: спазм коронарных артерий с развитием инфаркта, нарушения ритма сердца, критическую ишемию конечностей.
Относительные противопоказания включают сахарный диабет с признаками диабетической ангиопатии или нейропатии, неконтролируемую гипертензию (артериальное давление 160–179/100–109 мм рт.ст.), острые инфекционные заболевания с лихорадкой, обострение хронических воспалительных процессов, беременность во II–III триместрах, детский возраст до 5 лет, клаустрофобию (для общей криотерапии в камерах). В этих случаях криотерапию проводят после стабилизации состояния, коррекции гликемии, нормализации артериального давления или выбирают альтернативные методы лечения.
Почему диабетическая нейропатия повышает риски криотерапии
При диабетической нейропатии нарушается чувствительность кожи, что не позволяет пациенту адекватно оценить интенсивность холодового воздействия и глубину повреждения тканей. Здоровый человек рефлекторно отдёргивает руку при избыточном замораживании, ощущая резкую боль, тогда как пациент с нейропатией может не почувствовать критического охлаждения. Это приводит к непреднамеренной глубокой криодеструкции с формированием обширных некрозов. Кроме того, диабетическая ангиопатия замедляет заживление: если у здорового человека крионекроз эпителизируется за 10–14 дней, то при диабете процесс растягивается на 4–8 недель с высоким риском вторичной инфекции.
Цена ошибочного игнорирования противопоказаний может быть катастрофической: от госпитализации в реанимацию при анафилаксии до инвалидизации при ампутации пальцев. Перед проведением криотерапии необходим тщательный сбор анамнеза с акцентом на реакции организма на холод в прошлом, наличие сосудистых заболеваний, аутоиммунных нарушений. При малейшем подозрении на холодовую аллергию рекомендуют провести провокационный тест: приложить кубик льда к предплечью на 5 минут и оценить реакцию через 10 минут — появление волдыря служит абсолютным противопоказанием к криотерапии.
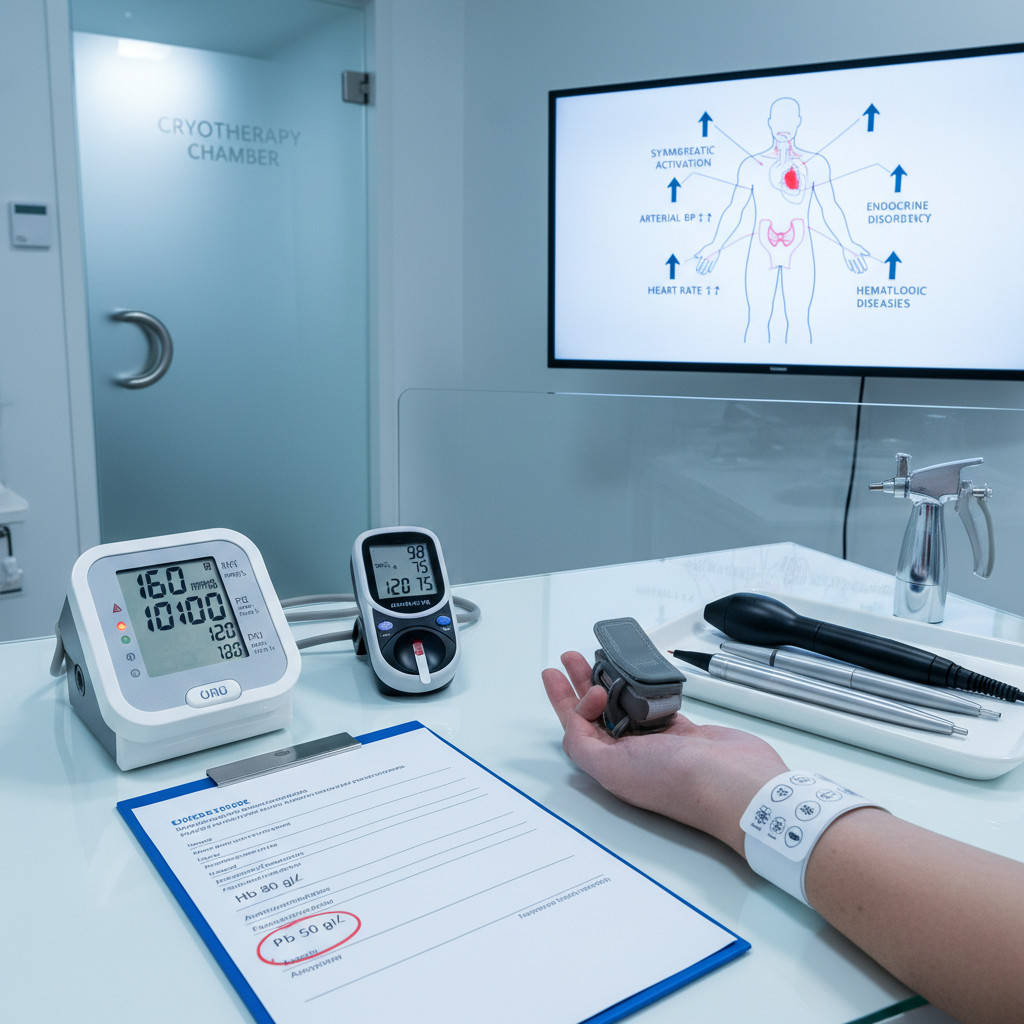
Системные заболевания как барьер для криотерапии
Системные заболевания, затрагивающие сердечно-сосудистую, эндокринную, иммунную и кроветворную системы, создают непреодолимые барьеры для применения криотерапии из-за риска системных осложнений, выходящих за пределы локального воздействия на кожу. В отличие от локальных ограничений (раны, инфекции кожи), системные противопоказания связаны с потенциальной декомпенсацией жизненно важных органов под влиянием холодового стресса.
Категория эндокринологических противопоказаний включает неконтролируемые заболевания щитовидной железы (тяжёлый гипотиреоз, тиреотоксикоз), надпочечниковую недостаточность, сахарный диабет 1 типа и сахарный диабет 2 типа с осложнениями в виде васкулопатии или ретинопатии. При тяжёлом гипотиреозе нарушена терморегуляция организма: пациенты не могут адекватно реагировать на холодовой стресс повышением теплопродукции, что приводит к гипотермии с брадикардией и угнетением сознания. Сахарный диабет с васкулопатией характеризуется поражением микроциркуляторного русла — дополнительное холодовое повреждение сосудов провоцирует некрозы и длительно незаживающие язвы.
Группа гематологических противопоказаний охватывает серповидноклеточную анемию, тяжёлую тромбоцитопению (число тромбоцитов менее 50×10/л), агамглобулинемию, состояния после химиотерапии с нейтропенией. При серповидноклеточной анемии охлаждение провоцирует полимеризацию аномального гемоглобина S с деформацией эритроцитов и окклюзией капилляров, что вызывает вазоокклюзионный криз с интенсивной болью и ишемией тканей. Тромбоцитопения 3–4 степени создаёт риск массивных кровотечений: криодеструкция с последующим формированием пузырей и отторжением некротизированных тканей может привести к профузному кровотечению, неконтролируемому из-за дефицита тромбоцитов.
- Облитерирующий атеросклероз
- Системное поражение артерий с сужением просвета атеросклеротическими бляшками. Холодовой спазм сосудов на фоне исходного стеноза приводит к критической ишемии с развитием гангрены дистальных отделов конечностей.
- Онкологические заболевания в активной фазе
- Текущее противоопухолевое лечение (химиотерапия, лучевая терапия) или прогрессирование злокачественного процесса. Криотерапия может стимулировать иммунную систему непредсказуемым образом, ускоряя диссеминацию опухоли или вызывая аутоиммунные реакции.
- Тяжёлая сердечная недостаточность
- Декомпенсированная недостаточность кровообращения III–IV функционального класса по NYHA. Холодовое воздействие повышает постнагрузку на сердце через периферический вазоспазм, провоцируя отёк лёгких и кардиогенный шок.
Механизм системных осложнений связан с холодовым стрессом — каскадом нейроэндокринных реакций на охлаждение. Даже локальная криодеструкция запускает выброс катехоламинов (адреналина, норадреналина), повышение артериального давления на 20–40 мм рт.ст., увеличение частоты сердечных сокращений на 15–25 ударов в минуту, активацию симпатической нервной системы. У здорового человека эти изменения компенсируются за 15–20 минут, тогда как при системных заболеваниях они провоцируют декомпенсацию: гипертонический криз при неконтролируемой гипертензии, приступ стенокардии при ишемической болезни сердца, гипергликемический криз при диабете.
Позиционный документ Международного института холодильной техники 2020 года рекомендует исключать от общей криотерапии лиц с неконтролируемой гипертензией, хронической мигренью, кардиопатиями, серповидноклеточной анемией, криоглобулинемией и тяжёлым гипотиреозом на основании анализа клинических исследований, опубликованных после 2006 года.
Категория временных противопоказаний включает острые инфекционные заболевания, артериальное давление ≥160/100 или ≤100/60 мм рт.ст. с признаками гемодинамической нестабильности, лихорадку, выраженную анемию (гемоглобин ≤80 г/л), электролитные нарушения, беременность, кахексию, текущую терапию кардиотоксичными или спазмогенными препаратами. После коррекции этих состояний криотерапия становится допустимой: нормализация температуры тела, стабилизация артериального давления, восполнение электролитов, завершение беременности снимают ограничения.
Аналогия с авиаперелётом: системные противопоказания к криотерапии подобны медицинским ограничениям к полётам — человек с тяжёлой сердечной недостаточностью не должен летать из-за риска декомпенсации при перепадах давления и гипоксии, точно так же пациент с синдромом Рейно не должен подвергаться криовоздействию из-за риска критической ишемии. В обоих случаях провоцирующий фактор (низкое давление/холод) создаёт нагрузку, с которой скомпрометированная система не справляется.
Как оценить риск перед криотерапией при пограничных состояниях
При пограничных состояниях (контролируемый диабет без осложнений, артериальная гипертензия 1 степени, ремиссия аутоиммунного заболевания более 6 месяцев) решение принимается индивидуально на основе функциональных проб. Рекомендуется провести пробное локальное криовоздействие на ограниченную зону (площадь не более 1 см) с мониторингом артериального давления, пульса, уровня глюкозы крови до и через 30 минут после процедуры. Отсутствие гипертензивной реакции (подъём АД менее 20 мм рт.ст.), тахикардии (прирост ЧСС менее 15 уд/мин), нормальное заживление тестовой зоны за 10–14 дней свидетельствуют о низком риске. При наличии патологических реакций от криотерапии следует отказаться в пользу альтернативных методов: лазерной деструкции, радиоволновой хирургии или хирургического иссечения.
Критический анализ показывает, что игнорирование системных противопоказаний в погоне за «простотой» и доступностью криотерапии создаёт неоправданные риски. Преимущество метода — отсутствие необходимости в анестезии и быстрота выполнения — превращается в недостаток при работе с пациентами, имеющими системную патологию. Альтернативные методы (электрокоагуляция, лазерная деструкция, хирургическое иссечение) при наличии системных заболеваний более контролируемы и предсказуемы, поскольку не создают генерализованного холодового стресса.
Локальные ограничения и зоны повышенного риска
Локальные противопоказания определяются анатомическими особенностями зоны воздействия, состоянием кожи и глубиной залегания жизненно важных структур под новообразованием. В отличие от системных ограничений, локальные барьеры связаны с риском функциональных или косметических осложнений в месте криодеструкции без угрозы для жизни пациента.
Зона наибольшего риска — периорбитальная область (веки, внутренний угол глаза, периокулярная кожа на расстоянии менее 5 мм от ресничного края). Криотерапия в этой локализации может вызвать повреждение конъюнктивы, роговицы, слёзных протоков с развитием эпифоры (постоянного слезотечения), блефароспазма, симблефарона (сращение конъюнктивы века с конъюнктивой глазного яблока). Зарегистрированы случаи стойкого снижения зрения после неосторожной криодеструкции папилломы на нижнем веке с образованием рубцового выворота века и хронического кератита.
Носогубные складки и кожа волосистой части головы представляют зоны с высокой частотой рецидивов — до 40% против 5–10% на коже туловища и конечностей. Механизм связан с особенностями кровоснабжения: интенсивная васкуляризация этих областей ускоряет согревание тканей, что приводит к недостаточной глубине заморозки. Кроме того, плотность волосяных фолликулов на голове затрудняет контроль границ ледяного шарика, а остаточные вирус-содержащие клетки в устьях фолликулов служат источником реинфекции.
- Область естественных отверстий
- Кожа вокруг рта, носа, ушных раковин, ануса, половых органов. Риск образования стриктур (сужений) при глубоком замораживании, болезненность процедуры из-за высокой плотности нервных окончаний, длительное заживление.
- Поражённая или воспалённая кожа
- Наличие активной инфекции (импетиго, герпес, грибковое поражение), открытых ран, ожогов, солнечного дерматита. Криовоздействие на фоне нарушенного барьера усугубляет воспаление и задерживает репарацию.
- Ранее облучённые зоны
- Кожа после лучевой терапии характеризуется фиброзом, атрофией, нарушением микроциркуляции. Криодеструкция провоцирует длительно незаживающие некрозы и радионекроз.
Кожа над поверхностно расположенными нервными стволами (локтевой нерв в области локтевого сустава, лучевой нерв на запястье, малоберцовый нерв у головки малоберцовой кости) требует особой осторожности. Чрезмерное замораживание вызывает нейропатию с парестезиями, гипестезией или полной потерей чувствительности в зоне иннервации. Описан случай стойкого пареза кисти после криодеструкции бородавки на тыле запястья с повреждением глубокой ветви лучевого нерва — восстановление заняло 8 месяцев при интенсивной реабилитации.
Исследование по локализации базальноклеточного рака показало, что криотерапия на коже волосистой части головы и в носогубных складках сопровождается частотой рецидивов 39–42% против 18–22% на коже щёк, лба и шеи при одинаковых протоколах заморозки.
Участки с тонкой кожей (веки, мошонка, внутренняя поверхность предплечья) и области с недостаточной подкожно-жировой клетчаткой (передняя поверхность голени, тыл кисти) несут повышенный риск глубокого некроза. Жировая ткань выполняет роль термоизолятора, ограничивая распространение холода в глубину — при её отсутствии температура −30°C достигается на уровне надкостницы, что провоцирует периостит с длительной болью и замедленным заживлением. На голени частота формирования атрофических рубцов после криодеструкции достигает 25% против 8–12% на плече или бедре.
Зоны постоянного механического воздействия — ладони, подошвы, ягодицы, область пояса — характеризуются медленным заживлением из-за постоянной травматизации формирующейся молодой кожи. Крионекроз на подошве эпителизируется за 21–28 дней против 10–14 дней на туловище, причём в первые две недели пациент вынужден ограничивать нагрузку на ногу, что снижает качество жизни. Аналогия с ремонтом дороги: попытка заасфальтировать участок, по которому продолжают ездить машины, обречена на провал — покрытие разрушится до полного затвердевания.
Почему криотерапию не применяют на красной кайме губ
Красная кайма губ (vermillion border) представляет переходную зону между кожей и слизистой оболочкой с уникальной анатомией: отсутствие рогового слоя, высокая плотность сосудов и нервов, постоянное увлажнение слюной. Криодеструкция в этой зоне вызывает формирование грубых деформирующих рубцов с нарушением контура губ у 40–50% пациентов. Кроме того, невозможно защитить слизистую полости рта от случайного попадания жидкого азота, что приводит к болезненным эрозиям и язвам. Для удаления новообразований на губах предпочтительны хирургическое иссечение с пластикой или лазерная вапоризация CO?-лазером, обеспечивающие контролируемую глубину воздействия и приемлемый косметический результат.
Цена ошибки при игнорировании локальных ограничений — функциональный или косметический дефект, устранение которого требует реконструктивной хирургии. Рубцовая деформация век с выворотом, стеноз носового хода после агрессивной криодеструкции, хронические нейропатические боли при повреждении нервов не компенсируются выигрышем во времени и стоимости первичной процедуры. Перед криотерапией в анатомически сложных зонах необходима консультация с обсуждением альтернативных методов: для периорбитальной области — хирургическое иссечение с гистологией, для носогубных складок — радиоволновая деструкция с минимальным термическим повреждением, для волосистой части головы — комбинация криодеструкции с последующей противовирусной терапией для снижения частоты рецидивов.
Контактные и бесконтактные методики: как проводят процедуру
Криотерапия в дерматологии реализуется двумя принципиально различными техниками: контактной (с применением криоаппликаторов, зондов или тампонов) и бесконтактной (распылением жидкого азота под давлением). Выбор методики определяется размером, локализацией и глубиной новообразования, а также доступностью оборудования и опытом врача.
Бесконтактная методика предполагает распыление жидкого азота из ручного или стационарного криораспылителя (типа Cry-Ac, Brymill) через сопло диаметром 1–5 мм. Врач держит распылитель перпендикулярно или под углом 30–45° к поверхности кожи на расстоянии 1–1,5 см и подаёт жидкий азот короткими импульсами длительностью 5–30 секунд до формирования ледяного шарика диаметром на 2–3 мм больше видимых границ поражения. Скорость охлаждения при распылении достигает 50°C в секунду, что обеспечивает образование мелких внутриклеточных кристаллов льда с максимальным повреждающим эффектом.
Преимущества распыления включают высокую скорость процедуры (10–60 секунд на один элемент), возможность обработки крупных и множественных поражений, минимальный контакт с кожей, что снижает риск инфицирования. Недостатки — сложность контроля глубины заморозки (зависит от субъективной оценки врача), риск повреждения окружающих тканей при недостаточной фиксации пациента или неточном прицеливании, потребление значительных объёмов жидкого азота (100–200 мл на сеанс при множественных новообразованиях).
| Характеристика | Бесконтактная методика (распыление) | Контактная методика (аппликаторы) |
|---|---|---|
| Скорость охлаждения | До 50°C/сек | 10–20°C/сек |
| Глубина проникновения | 3–5 мм | 1–3 мм |
| Точность воздействия | Средняя (зависит от навыка оператора) | Высокая (чёткие границы) |
| Время процедуры на 1 элемент | 10–30 секунд | 20–60 секунд |
| Расход жидкого азота | Высокий (100–200 мл/сеанс) | Низкий (20–50 мл/сеанс) |
| Болевые ощущения | Умеренные (3–5 по ВАШ) | Выраженные (5–7 по ВАШ) |
| Риск гипопигментации | 25–30% | 15–20% |
Контактная методика реализуется с помощью металлических криоаппликаторов (зондов) различной формы и диаметра — от 2 до 25 мм. Аппликатор предварительно погружается в жидкий азот на 10–15 секунд до полного охлаждения, затем плотно прижимается к новообразованию на 10–40 секунд в зависимости от протокола. Холод передаётся в ткани путём прямой теплопроводности, скорость охлаждения составляет 10–20°C в секунду — медленнее, чем при распылении, но с более чёткими границами зоны воздействия.
Особая разновидность контактного метода — техника с ватным тампоном, где деревянная палочка с намотанной ватой погружается в жидкий азот и затем прикладывается к коже. Этот способ применяется для поверхностных поражений малого размера (менее 5 мм), обработки труднодоступных участков (носогубные складки, межпальцевые промежутки), криомассажа при воспалительных дерматозах. Эффективность ниже, чем у распыления или металлических аппликаторов, поскольку ватный тампон быстро нагревается, требуя повторного погружения в азот каждые 3–5 секунд.
Сравнительное исследование турецких дерматологов 2019 года показало, что тангенциальное распыление (под углом 30–45°) менее болезненно, чем вертикальное (интенсивность боли 4,2 против 5,8 по 10-балльной шкале), при сопоставимой эффективности удаления бородавок — 68% против 71% после трёх сеансов.
Протокол проведения криодеструкции включает несколько этапов. Предварительная подготовка: очищение кожи антисептиком, при необходимости — локальное обезболивание кремом с лидокаином за 30–60 минут (для крупных или болезненных поражений). Для подошвенных бородавок обязательно парирование — удаление гиперкератотического слоя скальпелем для обеспечения контакта жидкого азота с вирус-содержащими клетками базального слоя.
Непосредственное замораживание: врач фиксирует кожу пальцами одной руки, натягивая её для выравнивания поверхности, и наносит жидкий азот выбранным способом до формирования ледяного шарика с «галло» (белым ободком) диаметром на 1–3 мм больше границ новообразования. Время экспозиции зависит от диагноза: 5–10 секунд для себорейных кератозов, 10–20 секунд для вульгарных бородавок, 20–30 секунд для актинических кератозов, 60–120 секунд с двумя циклами для поверхностной базальноклеточной карциномы.
Период оттаивания занимает в 1,5–2 раза больше времени, чем заморозка. При двухцикловой методике после полного оттаивания (исчезновение ледяного шарика, возвращение естественного цвета кожи) процедуру повторяют. Постпроцедурный уход: защита обработанной зоны стерильной повязкой, запрет на травматизацию и намокание в течение 48 часов, при формировании пузыря — асептическая пункция с сохранением «крыши» пузыря как биологической повязки.
Почему криозонды используют редко в амбулаторной дерматологии
Криозонды с замкнутым циклом циркуляции жидкого азота (типа Inomed) обеспечивают контролируемое охлаждение до −80…−89°C с поддержанием заданной температуры неограниченное время. Они позволяют формировать ледяной шарик заданного объёма под визуальным или УЗИ-контролем, что критично в нейрохирургии и онкологии. Однако стоимость системы превышает 50 000–80 000 евро, требуется специальная подготовка персонала, процедура занимает 20–40 минут против 1–2 минут при распылении. Для амбулаторной дерматологии, где 90% поражений — доброкачественные новообразования диаметром менее 10 мм, такие инвестиции экономически нецелесообразны. Криозонды оправданы при лечении крупных злокачественных опухолей, где требуется достижение летальной температуры −40°C на всём протяжении новообразования с минимальным повреждением здоровых тканей.
Критическая оценка методик показывает, что бесконтактное распыление оптимально для опытных дерматологов, работающих с высоким потоком пациентов: скорость, эффективность и универсальность перевешивают субъективность контроля. Контактная техника предпочтительна для начинающих специалистов, обработки единичных мелких элементов, работы с детьми (меньше пугает, чем шипящий распылитель). Ватные тампоны — архаичный метод, сохраняющийся в клиниках с ограниченным бюджетом, но уступающий современным способам по всем параметрам, кроме стоимости (деревянная палочка и вата стоят копейки против 15 000–40 000 рублей за ручной криораспылитель).
Криотерапия против лазера и электрокоагуляции: выбор с учетом компромиссов
Выбор между криотерапией, лазерной деструкцией и электрокоагуляцией представляет классический инженерный компромисс: каждый метод превосходит конкурентов по одним параметрам, уступая по другим. Оптимальное решение зависит от характера новообразования, доступности оборудования, опыта врача, эстетических ожиданий пациента и стоимости лечения.
Криотерапия характеризуется минимальной стоимостью расходных материалов (жидкий азот 50–150 рублей за литр), отсутствием необходимости в анестезии для большинства поражений, быстротой выполнения (30–120 секунд на элемент) и низким риском кровотечения (холод вызывает вазоконстрикцию). Эффективность для доброкачественных новообразований составляет 65–90% за один-три сеанса. Компромисс — невозможность гистологического исследования удалённой ткани, субъективность контроля глубины воздействия, высокая частота пигментных изменений (гипо- или гиперпигментация у 25–35% пациентов), необходимость повторных процедур.
Лазерная деструкция (CO?-лазер 10 600 нм, эрбиевый Er:YAG 2940 нм, импульсный лазер на красителях 585–595 нм) обеспечивает прецизионное удаление с контролем глубины до долей миллиметра, минимальное повреждение окружающих тканей за счёт сфокусированного луча, немедленную коагуляцию сосудов (бескровность), превосходный косметический результат с частотой рубцевания менее 5%. Эффективность достигает 88–94% за один сеанс для бородавок, папиллом, кератозов. Цена выбора — высокая стоимость процедуры (1500–8000 рублей за элемент против 300–1200 рублей при криодеструкции), необходимость инъекционной анестезии для крупных поражений, запах жжёной ткани, требовательность к квалификации оператора.
Электрокоагуляция (диатермокоагуляция, радиоволновая хирургия) предполагает разрушение ткани высокочастотным электрическим током с нагревом до 60–100°C. Метод универсален для всех типов доброкачественных новообразований, позволяет сохранить материал для гистологии (при иссечении радиоволновой петлёй), обеспечивает немедленный гемостаз. Эффективность 85–95% за один сеанс, частота рецидивов 5–12%. Компромиссы — болезненность процедуры (требуется местная анестезия), риск гипертрофических рубцов у лиц с келоидной предрасположенностью (8–15%), более длительное заживление (14–21 день против 10–14 дней при лазере), запах жжёной ткани.
| Параметр | Криотерапия | Лазер (CO?, Er:YAG) | Электрокоагуляция |
|---|---|---|---|
| Эффективность (одиночный сеанс) | 47–83% | 88–94% | 85–95% |
| Частота рецидивов | 20–40% | 8–15% | 5–12% |
| Потребность в анестезии | Редко (крупные элементы) | Часто (крупные элементы) | Всегда |
| Стоимость процедуры | 300–1200 руб/элемент | 1500–8000 руб/элемент | 800–3000 руб/элемент |
| Время заживления | 10–21 день | 7–14 дней | 14–21 день |
| Риск гипопигментации | 25–35% | 5–10% | 8–12% |
| Возможность гистологии | Нет | Нет (вапоризация) | Да (радиоволновая петля) |
| Глубина контроля | Низкая (субъективная) | Высокая (послойно) | Средняя (визуальная) |
Сравнительное исследование методов лечения актинического кератоза выявило парадокс: при краткосрочном наблюдении (3 месяца) CO?-лазер превосходил криотерапию (полное разрешение в 93% против 72%), однако при 12-месячном контроле криотерапия демонстрировала более низкую частоту рецидивов (33,2% против 63% в лазерной группе). Объяснение кроется в иммуностимулирующем эффекте криодеструкции: разрушенные холодом клетки высвобождают антигены, активирующие локальный иммунитет против остаточных атипичных кератиноцитов.
Для вирусных бородавок мета-анализ 11 исследований показал, что CO?-лазер в два раза эффективнее криотерапии по показателям полного излечения, частоты рецидивов и осложнений. Однако криотерапия остаётся методом первой линии из-за экономической доступности и простоты: лазерное удаление стоит в 3–5 раз дороже, требует специализированного оборудования стоимостью 800 000–3 500 000 рублей, недоступного большинству амбулаторных клиник.
По данным систематического обзора 2023 года, опубликованного в Dermatologic Surgery, лазерная деструкция генитальных кондилом обеспечивает 88–94% эффективности с частотой рецидивов 15–22%, превосходя криотерапию (63–75% успеха, 25–35% рецидивов), но уступая хирургическому иссечению по долгосрочным результатам.
Аналогия с транспортом помогает понять компромиссы: криотерапия — это автобус (доступно, массово, не всегда комфортно, средняя скорость), лазер — бизнес-джет (быстро, комфортно, дорого, требует инфраструктуры), электрокоагуляция — такси (универсально, надёжно, средняя цена, промежуточный вариант). Выбор зависит от бюджета, срочности и требований к результату.
Для единичных мелких себорейных кератозов или вирусных бородавок у пациентов с ограниченным бюджетом криотерапия оптимальна. При множественных актинических кератозах на лице, где косметический результат критичен, предпочтителен CO?-лазер с фракционным режимом. Для удаления атипичных новообразований, требующих гистологического исследования, выбор — радиоволновая эксцизия с последующей гистологией. При келоидной предрасположенности оптимальна криотерапия (минимальный риск рубцевания), при тёмной коже — лазер (меньше пигментных изменений).
Почему комбинация методов иногда превосходит монотерапию
Последовательное применение криотерапии и электрокоагуляции для лечения резистентных подошвенных бородавок повышает эффективность с 41–65% до 78–85%. Протокол: первый этап — криодеструкция с двойным циклом для разрушения основной массы бородавки и стимуляции иммунного ответа, через 14 дней — электрокоагуляция остаточных элементов для полного удаления. Механизм синергии: криодеструкция «подготавливает почву», вызывая некроз и воспаление, что улучшает кровоснабжение зоны; последующая электрокоагуляция разрушает оставшиеся вирус-содержащие клетки в условиях активированного иммунитета. Недостаток — удвоение стоимости и времени лечения, поэтому комбинацию применяют только при неэффективности монотерапии.
Критический взгляд показывает, что в России выбор метода часто определяется не медицинскими показаниями, а доступностью оборудования. Амбулаторные кабинеты дерматовенерологических диспансеров оснащены жидким азотом и распылителями, но лишены CO?-лазеров из-за бюджетных ограничений. Частные клиники, напротив, активно продвигают лазерные технологии, завышая их преимущества и умалчивая о достоинствах криотерапии. Объективная оценка требует учёта всех факторов: эффективности, стоимости, косметического результата, доступности, необходимости гистологии, локализации поражения и предпочтений пациента.
Какие осложнения возможны после воздействия холодом
Осложнения криотерапии подразделяются на немедленные (возникающие в течение первых 24 часов), ранние (2–14 дней) и отсроченные (спустя 2 недели и более). Общая частота нежелательных явлений составляет 15–35% в зависимости от агрессивности протокола, локализации обработки и индивидуальных особенностей пациента.
Немедленные осложнения включают боль интенсивностью 3–7 баллов по визуальной аналоговой шкале (ВАШ), возникающую во время процедуры и сохраняющуюся 2–6 часов после неё. Механизм связан с прямым холодовым раздражением ноцицепторов и последующим реперфузионным повреждением при согревании тканей. Боль наиболее выражена при обработке зон с высокой плотностью нервных окончаний: пальцы рук и ног, периорбитальная область, красная кайма губ. Приём анальгетиков (ибупрофен 400 мг, парацетамол 500 мг) за 30 минут до процедуры снижает интенсивность болевых ощущений на 30–40%.
Отёк тканей развивается у 40–60% пациентов в течение 6–12 часов после криодеструкции, достигая максимума к 24–48 часам. При обработке периорбитальной зоны отёк может быть настолько выраженным, что затрудняет открывание глаза на 2–3 дня. Вазогенная природа отёка обусловлена повышением проницаемости капилляров под влиянием медиаторов воспаления (гистамин, брадикинин, простагландины). Применение холодных компрессов в первые 6 часов и возвышенное положение обработанной конечности уменьшают выраженность отёка.
- Пузыри (буллы)
- Формируются у 44–64% пациентов при агрессивных протоколах (двойной цикл, экспозиция более 20 секунд). Представляют собой скопление серозной жидкости между эпидермисом и дермой. Пузыри диаметром менее 1 см обычно рассасываются самостоятельно за 7–10 дней, крупные требуют асептической пункции с сохранением «крыши» как биологической повязки.
- Кровотечение
- Редкое осложнение (менее 2%), возникающее при отторжении некротизированной ткани на 5–10 день. Факторы риска включают приём антикоагулянтов, тромбоцитопению, васкуляризированные новообразования. Останавливается давящей повязкой или прижиганием нитратом серебра.
- Обморок (вазовагальная реакция)
- Развивается у 1–3% пациентов как психогенная реакция на процедуру или вследствие резкого выброса катехоламинов при холодовом стрессе. Проявляется головокружением, тошнотой, бледностью, падением артериального давления.
Исследование осложнений криотерапии себорейных кератозов показало, что гипопигментация возникает у 6,3% пациентов после повторных сеансов, тогда как при электрокоагуляции частота атрофических рубцов составляет 3,1%, что делает методы сопоставимыми по безопасности.
Ранние осложнения включают инфицирование обработанной зоны (2–5% случаев), особенно при несоблюдении правил асептики или преждевременном удалении «крыши» пузыря. Клинически проявляется нарастающей болью, гнойным отделяемым, гиперемией и отёком окружающих тканей. Лечение — топические антибиотики (мупироцин, фузидиевая кислота) или системная антибиотикотерапия при распространённом процессе.
Головная боль отмечается у 5–8% пациентов после обработки новообразований на лице и волосистой части головы, связана с рефлекторным спазмом сосудов и обычно купируется нестероидными противовоспалительными препаратами. Невропатия с нарушением чувствительности развивается при чрезмерном замораживании над поверхностно расположенными нервными стволами — восстановление занимает от 4 недель до 8 месяцев в зависимости от степени повреждения.
Отсроченные осложнения представлены пигментными изменениями (гипо- и гиперпигментация), рубцеванием (гипертрофические и атрофические рубцы), рецидивами новообразования, стойким изменением текстуры кожи. Частота и выраженность этих осложнений зависит от фототипа кожи, локализации, глубины криовоздействия и индивидуальных особенностей регенерации. Детальное рассмотрение пигментных нарушений и рубцевания представлено в следующем разделе.
Как минимизировать риск осложнений криотерапии
Профилактика осложнений начинается с тщательного отбора пациентов: исключение противопоказаний, коррекция гемостаза при необходимости, отмена антикоагулянтов за 5–7 дней до процедуры (по согласованию с кардиологом). Выбор консервативного протокола (одиночный цикл 10–15 секунд) для первого сеанса позволяет оценить индивидуальную реакцию без риска выраженных осложнений. Защита окружающих здоровых тканей вазелином или жирным кремом снижает латеральное распространение холода. Постпроцедурные рекомендации включают защиту от солнечного облучения (SPF 50+) в течение 3 месяцев для профилактики пигментных нарушений, ежедневную обработку антисептиками до полной эпителизации, запрет на механическую травматизацию корок и пузырей. При малейших признаках инфекции — немедленное обращение к врачу.
Аналогия с заморозкой продуктов: как при быстрой заморозке овощей образуются кристаллы льда, разрушающие клеточные стенки, так и при криотерапии повреждение тканей неизбежно. Задача врача — найти баланс между достаточной глубиной разрушения патологических клеток и минимизацией повреждения здоровых структур. Переморозка ведёт к глубоким некрозам и рубцам, недостаточная экспозиция — к рецидивам и необходимости повторных процедур.
Пигментные изменения и рубцевание: факторы риска
Гипопигментация (стойкое осветление кожи в зоне воздействия) представляет наиболее частое отсроченное осложнение криотерапии с частотой 25–35% у светлокожих пациентов (фототипы I–III по Фитцпатрику) и до 40–50% у лиц с тёмной кожей (фототипы IV–VI). Механизм связан с избирательной чувствительностью меланоцитов к холоду: эти клетки погибают при температуре −5…−7°C, тогда как кератиноциты требуют охлаждения до −20°C для необратимого повреждения.
Меланоциты располагаются в базальном слое эпидермиса и имеют длинные отростки (дендриты), доставляющие пигмент меланин в окружающие кератиноциты. При криодеструкции происходит селективная гибель меланоцитов через механическое повреждение дендритов кристаллами льда, денатурацию ферментов меланогенеза (тирозиназы) и нарушение транспорта меланосом. Восстановление популяции меланоцитов путём миграции из волосяных фолликулов занимает 3–12 месяцев, однако при глубоком замораживании или повторных процедурах репигментация может не наступить.
Факторы риска стойкой гипопигментации включают фототип кожи IV–VI (в 1,8–2,2 раза выше, чем у светлокожих), обработку зон с исходной гиперпигментацией (лентиго, хлоазма), агрессивные протоколы (двойной цикл, экспозиция более 20 секунд), локализацию на коже с низкой плотностью волосяных фолликулов (голени, предплечья), повторные процедуры на одном участке с интервалом менее 4 недель. Исследование внутрирубцовой криотерапии келоидов показало восстановление пигментации у 69% пациентов через 12 месяцев, однако у 31% депигментация оставалась стойкой.
Сравнительный анализ контактной и внутрирубцовой криотерапии выявил, что при контактной методике выраженная депигментация развивается у 91% пациентов (19 из 21), тогда как при внутрирубцовой технике депигментации не наблюдалось ни у одного из 24 пациентов, что объясняется отсутствием прямого воздействия на эпидермальные меланоциты.
Гиперпигментация (потемнение кожи) встречается реже — у 8–15% пациентов, преимущественно на фоне воспалительной реакции (поствоспалительная гиперпигментация). Факторы риска включают тёмную кожу, инсоляцию в первые 3 месяца после процедуры, травматизацию корок с затяжным заживлением. Гиперпигментация обычно регрессирует самостоятельно за 3–6 месяцев, ускорить процесс помогают депигментирующие кремы с гидрохиноном 4%, койевой кислотой или арбутином.
| Фактор риска | Влияние на гипопигментацию | Влияние на рубцевание |
|---|---|---|
| Фототип IV–VI | Риск в 2,2 раза выше | Риск келоидов в 15 раз выше |
| Агрессивный протокол (двойной цикл) | Частота 35–40% против 25% | Частота рубцов 12–18% против 5–8% |
| Локализация на голенях | Восстановление дольше на 4–6 месяцев | Атрофические рубцы у 25% |
| Повторные процедуры | Кумулятивное повреждение меланоцитов | Фиброз, гипертрофия |
| Инсоляция в первые 3 месяца | Усиление гипопигментации | Гипертрофия рубца |
Рубцевание после криотерапии развивается реже, чем при термических методах (электрокоагуляция, лазер), но остаётся значимой проблемой у 5–18% пациентов. Различают атрофические рубцы (западение поверхности из-за недостаточной регенерации дермы) и гипертрофические/келоидные рубцы (избыточное разрастание соединительной ткани). Атрофия характерна для зон с тонкой кожей и недостаточной васкуляризацией (голени — 25%, тыл кисти — 15%), келоиды — для лиц негроидной расы и азиатов (частота в 15 раз выше, чем у европеоидов).
Механизм рубцевания связан с глубиной криодеструкции: при достижении температуры −40°C и ниже на уровне ретикулярной дермы происходит необратимое повреждение фибробластов, коллагеновых и эластиновых волокон. Репаративная регенерация приводит к формированию рубцовой ткани с дезорганизованной структурой коллагена, отсутствием придатков кожи (волосяных фолликулов, сальных желёз) и изменённой архитектоникой сосудов. Избыточная продукция коллагена I типа при дефиците коллагеназ формирует гипертрофический рубец.
Профилактика пигментных нарушений включает индивидуальный подбор экспозиции с учётом фототипа (сокращение времени на 30–40% для тёмной кожи), использование тест-заморозки на незаметном участке для оценки реакции, строгую фотопротекцию (SPF 50+) в течение 6 месяцев после процедуры. Профилактика рубцевания предполагает отказ от агрессивных протоколов в зонах риска, применение силиконовых гелей (Dermatix, Kelo-cote) с первых дней эпителизации для модуляции фиброгенеза, раннее обращение к дерматологу при признаках гипертрофии для назначения внутрирубцовых инъекций кортикостероидов.
Можно ли вылечить стойкую гипопигментацию после криотерапии
Стойкая гипопигментация длительностью более 12 месяцев считается необратимым осложнением из-за полной гибели меланоцитов в зоне воздействия. Частичное улучшение (на 20–40%) возможно при применении узкополосной фототерапии 311 нм (стимулирует миграцию меланоцитов из волосяных фолликулов) курсом 30–40 сеансов 3 раза в неделю. Топические иммуномодуляторы (такролимус 0,1%, пимекролимус 1%) в сочетании с фототерапией повышают эффективность до 50–60%. Однако полное восстановление пигментации достигается редко (менее 15% случаев). Альтернатива — камуфлирующая косметика или татуаж медицинский для маскировки дефекта. Оптимальная стратегия — предотвращение гипопигментации путём консервативных протоколов криотерапии, особенно у пациентов с тёмной кожей.
Критический анализ показывает, что пигментные изменения и рубцевание — неизбежная цена агрессивных протоколов криотерапии. Компромисс между эффективностью деструкции и косметическим результатом требует учёта индивидуальных факторов риска. Для пациентов с келоидной предрасположенностью или фототипом V–VI криотерапия на открытых участках тела (лицо, шея, кисти) несёт высокий риск косметических осложнений, перевешивающий преимущества метода. В таких случаях предпочтительны альтернативные технологии с меньшим риском диспигментации: фракционный CO?-лазер, радиоволновая хирургия или хирургическое иссечение.

Взгляд критика: почему криотерапия не всегда оптимальна
Криотерапия в дерматологии, несмотря на вековую историю применения и широкую доступность, имеет фундаментальные ограничения, делающие её субоптимальным выбором в ряде клинических ситуаций. Критический анализ метода выявляет три ключевые проблемы: субъективность контроля, невозможность гистологической верификации и непредсказуемость косметического результата.
Первая проблема заключается в отсутствии объективных методов контроля глубины и температуры замораживания в реальном времени. Большинство дерматологов ориентируются на визуальные признаки (формирование ледяного шарика диаметром на 1–3 мм больше новообразования, побеление кожи) и тактильные ощущения, что вносит значительную вариабельность в результаты. Один и тот же 10-секундный распыл жидкого азота может обеспечить температуру −25°C на глубине 3 мм у пациента с толстой кожей и −35°C у пациента с тонкой атрофичной кожей. Отсутствие температурных датчиков в 95% амбулаторных кабинетов превращает криотерапию в метод с неконтролируемым результатом.
Вторая критическая проблема — невозможность гистологического исследования удалённой ткани. При криодеструкции патологические клетки разрушаются на месте с последующей резорбцией некротических масс, что исключает морфологическую верификацию диагноза. Это создаёт риск неправильного лечения: атипичный невус, принятый за себорейный кератоз, остаётся нераспознанной меланомой; атипичная бородавка на тыле кисти оказывается плоскоклеточным раком in situ. Частота ошибочной диагностики при клиническом осмотре составляет 5–12% для опытных дерматологов и до 25% для врачей общей практики.
Американская академия дерматологии в клиническом руководстве 2015 года рекомендует воздерживаться от криотерапии при любых новообразованиях с признаками атипии (асимметрия, неровные края, неоднородная окраска, диаметр более 6 мм, изменения во времени) до получения гистологического подтверждения доброкачественности.
Третья проблема — высокая частота косметически значимых осложнений. Гипопигментация развивается у 25–50% пациентов в зависимости от фототипа, причём у трети пациентов депигментация остаётся стойкой более 12 месяцев. Для новообразований на лице это означает выбор между удалением эстетического дефекта (бородавки, кератома) и риском формирования белого пятна, которое может быть косметически более заметным, чем исходное поражение. Лазерная деструкция CO?-лазером обеспечивает гипопигментацию лишь в 5–10% случаев при сопоставимой эффективности.
Проблема рецидивов ставит под сомнение экономическую эффективность криотерапии. При частоте рецидивов вирусных бородавок 20–40% необходимость повторных процедур увеличивает суммарную стоимость лечения до уровня более дорогих, но радикальных методов. Пациент, заплативший 800 рублей за криодеструкцию бородавки трижды с трёхнедельным интервалом (суммарно 2400 рублей), мог бы получить одномоментное лазерное удаление за 2500 рублей с частотой рецидива 8–15% вместо 30%.
Контраргументом служит иммуностимулирующий эффект криотерапии: разрушенные холодом клетки высвобождают антигены, активирующие локальный иммунитет. Это объясняет парадокс, обнаруженный в исследованиях актинического кератоза: при 12-месячном наблюдении криотерапия демонстрирует более низкую частоту рецидивов (33,2%), чем CO?-лазер (63%), несмотря на меньшую первичную эффективность. Однако клиническая значимость этого эффекта ограничена предраковыми состояниями и не распространяется на вирусные поражения, где персистенция ВПЧ в окружающей коже нивелирует любой иммуностимулирующий эффект.
Болезненность процедуры недооценивается пропагандистами метода. Распространённое утверждение, что «криотерапия не требует анестезии», справедливо лишь для поверхностных новообразований диаметром менее 5 мм. Обработка крупных подошвенных бородавок или глубоких актинических кератозов с двойным циклом замораживания вызывает интенсивную боль 5–7 баллов по ВАШ, сохраняющуюся 4–6 часов. Для сравнения: лазерная деструкция под инъекционной анестезией обеспечивает полную безболезненность как во время, так и после процедуры.
Аналогия с ремонтом автомобиля: криотерапия подобна «гаражному» ремонту — быстро, дёшево, без сложного оборудования, но с непредсказуемым результатом и отсутствием гарантий. Лазерная или радиоволновая хирургия — это «официальный сервис» с диагностическим оборудованием, контролем качества и гарантией на работу. Выбор зависит от приоритетов: если критична минимальная стоимость и доступность — криотерапия оправдана, если важен предсказуемый косметический результат и минимальный риск рецидива — следует выбрать альтернативные методы.
Почему криотерапия остаётся популярной, несмотря на недостатки
Доминирование криотерапии в амбулаторной дерматологической практике России объясняется тремя факторами: экономическим (жидкий азот стоит 50–150 рублей за литр против 800 000–3 500 000 рублей за CO?-лазер), организационным (не требуется лицензирование, как для хирургических манипуляций) и инерцией медицинского сообщества (метод преподаётся в медицинских вузах на протяжении десятилетий). Кроме того, отсутствие прямого сравнения методов в реальной клинической практике позволяет сохранять иллюзию равной эффективности. Пациент, получивший гипопигментацию после криодеструкции, редко осознаёт, что альтернативный метод мог бы обеспечить лучший результат — он просто не знает о существовании альтернатив. Смещение в сторону более совершенных технологий происходит медленно, по мере оснащения клиник лазерным оборудованием и роста информированности пациентов.
Оптимальная ниша криотерапии в современной дерматологии — лечение множественных поверхностных доброкачественных новообразований (более 10–15 элементов) в зонах, где косметический результат не критичен (туловище, конечности), у пациентов с ограниченным бюджетом или непереносимостью анестетиков. Для единичных новообразований на открытых участках тела, атипичных поражений, требующих гистологии, и пациентов с тёмной кожей криотерапия не является методом выбора. Объективная оценка соотношения пользы и рисков требует честного информирования пациента о существовании альтернатив с лучшим профилем эффективности и безопасности.
Криотерапия остаётся методом выбора для лечения множественных доброкачественных новообразований благодаря минимальной стоимости (300–1200 рублей за элемент против 1500–8000 рублей за лазерную деструкцию) и отсутствию необходимости в сложном оборудовании, однако компромиссом служат высокая частота пигментных изменений (25–35%), рецидивов (20–40%) и субъективность контроля глубины воздействия. Для единичных новообразований на лице оптимальна лазерная деструкция CO? или Er:YAG с эффективностью 88–94% и риском гипопигментации менее 10%, тогда как электрокоагуляция предпочтительна при необходимости гистологического исследования и обеспечивает частоту рецидивов 5–12%. Пациентам с тёмной кожей (фототипы IV–VI), келоидной предрасположенностью или локализацией поражения в зонах повышенного риска (периорбитальная область, носогубные складки, красная кайма губ) следует обсудить со специалистом альтернативные методы с меньшим риском косметических осложнений. Окончательный выбор методики определяется характером новообразования, его локализацией, индивидуальными факторами риска, бюджетом пациента и требованиями к косметическому результату — универсального решения не существует, каждый случай требует взвешенной оценки соотношения пользы и рисков.
Запишитесь на консультацию дерматолога для выбора оптимального метода удаления новообразований с учётом вашего фототипа, локализации поражения и эстетических ожиданий. Имеются противопоказания. Необходима консультация специалиста.
Об авторе: Черноброва Дарья Захаровна — специалист с квалификацией подолога, детского подолога и спортивного врача. Профессионально занимается диагностикой и лечением заболеваний стоп у пациентов всех возрастов, включая профессиональных спортсменов и любителей активного образа жизни. Специализируется на профилактике и лечении травм стоп, связанных с физическими нагрузками, применяет современные методики для быстрого восстановления и возвращения к активности.





